胰腺中的胰岛包含有分泌胰岛素的β细胞和分泌胰高血糖素的α细胞,胰岛素和胰高血糖素是两种特殊的激素,其能协同作用来调节机体血糖水平,β细胞的破坏和功能异常会导致糖尿病发生,目前并没有疗法能够阻断糖尿病进展及其严重的血管并发症。胰岛移植通常能够让机体血糖水平正常数年时间,且能阻断糖尿病次级并发生的出现,然而器官供体很少,因此临床上迫切需要胰岛细胞的替代来源,在这一方面,干细胞衍生的细胞是非常有希望的,近日一项刊登在国际杂志Nature上的研究报告中,Veres等人绘制出了干细胞分化为胰岛样细胞的分子过程图谱,相关研究工作或为后期制造用于移植的胰岛细胞提供了重要的基础。
人类多能干细胞能够无限自我更新并在体内分化成为多种类型的细胞,因此研究人员目前正在开发一些体外策略来通过干细胞来产生具有分化特性的胰岛细胞;而其中一种理想的方案就是促进干细胞分化为完全成熟的α细胞和β细胞,随后将其分离、纯化并且重新组装成为胰岛样结构用来进行移植,为了实现这一目标,研究人员就需要完全理解所有胰岛细胞的分化程序以及胰岛被构建的方式。
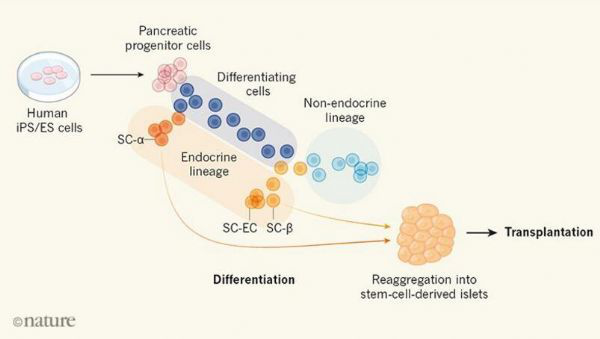
研究者Veres等人在干细胞分化为胰腺祖细胞和产生激素(内分泌)细胞的过程中,在不同的时间点对超过10万个细胞进行了分析检测,在分化过程的每个阶段对细胞样本进行单细胞RNA测序,随后进行计算机分析,并且鉴别细胞类型及追踪细胞随着时间延续的谱系变化。随后研究人员绘制出了胰腺祖细胞发育成为不同谱系的分化细胞的图谱(下图),目前通过干细胞来产生特殊分化细胞的方法具有可变的效率,主要是因为细胞异质性的存在及缺乏对分化过程所需分子信号转导因子的了解,因此研究人员绘制出的体外胰岛细胞的分化图谱或能为未来开发新型的分化步骤/过程提供一定的思路和信息。
研究者发现,胰腺祖细胞能够有效分化,然而,用略微不同的信号因子组合处理的祖细胞往往会产生不同比例的表达激素和非内分泌的细胞类型,这就表明,祖细胞的规范化是产生理想所需肿么分化细胞类型的关键,这项研究中,研究者提到的三种最丰富的表达激素的细胞类型分别为干细胞衍生的α细胞(SC-α)、β细胞(SC-β)和类似肠嗜铬细胞的细胞(SC-EC),肠嗜铬细胞通常存在于肠道中并能产生血清素,其有助于肠胃运动和消化的调节。
有意思的是,在没有外部信号因子的情况下分化并能够生长5周的β细胞能够保持其特定的分子和功能特性,而且,这些细胞在整个期间能够展现出稳定的葡萄糖刺激胰岛素分泌特性,研究结果表明,葡萄糖反应性是β细胞的稳定特性,其并不需要外源因子,如果β细胞将来用于抗糖尿病药物的筛选则具有一定的相关性。研究者还观察到,表达两种胰岛激素(胰岛素和胰高血糖素)的细胞可能是不成熟的α细胞,因为其全基因组表达谱与人类胰岛α细胞相匹配,这些多激素细胞在培养5周后会变成产单激素、表达胰高血糖素的细胞,这与此前的观察结果一致。
鉴别出SC-EC让研究人员非常惊讶,因为正常情况下肠嗜铬细胞并不存在于胰腺中,值得注意的是,当移植到小鼠机体中后其能长达8周时间保持稳定状态,当研究者改变其在分化阶段给予细胞的信号因子混合物时,SC-EC与胰腺内的分泌细胞的比例发生了显著的变化,这与体内肠道和胰腺的诱导和模式相匹配;观察结果表明,胰腺和肠道祖细胞的特异性对于器官特异性的分泌细胞的产生非常必要,不同组合的信号因子能够产生不同比例的非增值性内分泌细胞类型和增殖性内分泌细胞类型(腺泡和导管胰腺细胞)。
为了设计安全且功能成熟的干细胞衍生的胰岛等同物,研究者就必须分类和纯化所需的内分泌细胞类型,然后重新聚合成为假性胰岛,研究者发现,简单的解离和再聚合过程就能从培养物中移除大部分增殖性的非内分泌细胞,此外,他们也发现,整联蛋白α1能够作为SC-β细胞所表达的表面分子,利用整联蛋白α1抗体对磁性细胞进行分选就能让研究人员获取含有80%SC-β细胞的培养物。
内分泌的诱导(即胰腺中产生激素的细胞类型的产生)是干细胞分化为胰岛细胞的关键步骤,研究者对大约5万个单一细胞进行基因表达分析就能帮助其利用此前开发的排序技术重建人类胰腺祖细胞和分化的内分泌细胞之间的谱系关系,此外其还揭示了这些细胞类型出现的顺序,及沿着每个分化轨迹所发生的动态分子变化,其它研究则利用scRNA测序和计算分析来产生序列并模拟胚胎发育过程中涉及的细胞动态变化,这种组合方法能够优化不同步骤的时序。
那么我们与β细胞替代治疗产品距离还有多远呢?目前一项临床试验正在进行,旨在测试将干细胞衍生的胰腺祖细胞移植到1型糖尿病患者中的安全性和有效性,目的是恢复患者机体血液中葡萄糖的水平。然而,移植的胰腺祖细胞仍然需要分化并且成熟为β细胞来实现有效的葡萄糖刺激激素的分泌,由于研究人员无法控制细胞在体内所暴露的信号因子,因此就需要开发处于中产物来分泌胰岛素对葡萄糖产生反应(当细胞处于培养状态时),同时一旦其被移植就会变得非常有效;此外,仅移植SC-β细胞或许并不足以治疗1型糖尿病,因为α细胞对于严格控制人类机体胰岛素的分泌及葡萄糖水平的整体调控也是非常必要的。
研究者Veres等人在解决部分问题上取得了重要的成就,他们提供了scRNA-seq的数据集,其涵盖了胰岛细胞在体外分化的重要步骤,当在不同步骤中信号因子发生改变时这或许对于表征所产生细胞的特征非常重要,这项研究的一个关键之处在于研究者发现了SC-α和SC-β能够一起产生,但肠道内分泌的SC-EC和增殖性的非内分泌细胞也能够出现,这或许会生产安全的治疗产品很重要,这类产品需要高纯度分离SC-α和SC-β细胞,同时还要去除增殖性的祖细胞来避免癌症发生的风险。最后,研究人员对scRNA-seq数据集的深入分析或能帮助鉴别新的表面标志物和信号通路,这或将进一步改善胰岛细胞分化和纯化的程序,总体而言,这项研究或能帮助研究人员在临床上更加接近β细胞的替代治疗。
Sean